Глоссарий (словарь химических терминов)
приведены основные термины курса
Специальные | А | Б | В | Г | Д | Е | Ё | Ж | З | И | К | Л | М | Н | О | П | Р | С | Т | У | Ф | Х | Ц | Ч | Ш | Щ | Э | Ю | Я | Все
" |
|---|
"Провал электрона"то же, что "проскок электрона". | |
А |
|---|
Авогадро число(или постоянная Авогадро): NA = 6,02.1023 частиц вещества | |
адсорбцияконцентрирование какого-либо вещества на поверхности раздела фаз. Например, концентрирование молекул газа (адсорбата) на твердой поверхности (адсорбенте). В качестве адсорбентов используют, как правило, пористые тела с сильно развитой поверхностью (пример - активированный уголь). Адсорбция может быть результатом действия только физических сил между частицами вещества, но может сопровождаться и химическим взаимодействием адсорбата с адсорбентом (хемосорбция). | |
активированный комплекссм. переходное состояние | |
акцепторные свойстваспособность атомов элемента притягивать (удерживать) электроны. Количественной мерой акцепторных свойств атомов, образующих химическую связь, является их электроотрицательность. | |
аллотропияявление существования химического элемента в виде двух или нескольких простых веществ, различных по строению и свойствам. Эти простые вещества, различные по строению и свойствам, называются аллотропными формами или аллотропными модификациями. Например, графит и алмаз - две аллотропные формы (модификации) углерода, молекулярный кислород и озон - две аллотропные модификации кислорода. При определенных условиях аллотропные модификации могут переходить друг в друга. | |
аморфное вещество- не кристаллическое вещество, т.е. вещество, не имеющее кристаллической решетки. Примеры: бумага, пластмассы, резина, стекло, а также все жидкости. | |
амфотерностьспособность некоторых химических соединений проявлять кислотные или основные свойства в зависимости от веществ, которые с ними реагируют. Амфотерные вещества (амфолиты) ведут себя как кислоты по отношению к основаниям и как основания - по отношению к кислотам. | |
анионы- отрицательно заряженные ионы. | |
атом- наименьшая частица химического элемента, являющаяся носителем его свойств. Атом построен из субатомных частиц - протонов, нейтронов, электронов. | |
атомная единица массы (а.е.м.)- ровна 1/12 части массы атома углерода 126C, в ядре которого 6 протонов и 6 нейтронов, а в электронной оболочке 6 электронов. Другое название - углеродная единица. Единица, в которой измеряют массу атомов, молекул и субатомных частиц | |
атомный номер- то же, что порядковый номер элемента в Периодической системе Д.И.Менделеева. Атомный номер численно равен положительному заряду ядра этого элемента, т.е. числу протонов в ядре данного элемента. | |
атомный остовядро с частью электронной оболочки атома, не принимающей участия в образовании химической связи (то есть необобществленные электроны в совокупности с ядром) | |
В |
|---|
валентность- число электронных пар, с помощью которых атом данного элемента связан с другими атомами. | |
водородная связьодин из видов межмолекулярных связей. Обусловлена в основном электростатическими силами. Для возникновения водородной связи нужно, чтобы в молекуле был один или несколько атомов водорода, связанных с небольшими, но электроотрицательными атомами, например: O, N, F. Например, молекулы HF связаны между собой водородными связями, которые на рисунке показаны пунктирными линиями:
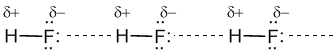 | |
восстановительвещество, способное отдавать электроны другому веществу (окислителю). | |
восстановление- химическая реакция, при которой электроны передаются данному веществу. | |
Г |
|---|
гетерогенные реакции- это химические реакции между веществами, находящимися в разных фазах (разных агрегатных состояниях вещества). Например, реакция горения угля - гегерогенная реакция между твердым углеродом и газообразным кислородом. Гетерогенные реакции протекают не в объеме, а на границе раздела фаз - в этом их принципиальное отличие от гомогенных реакций. | |
гибридизация- Теоретическое представление, с помощью которого удается связать между собой физическую картину строения атома и определяемую опытным путем геометрию молекул . Например, атом углерода имеет s- и p-орбитали, но в молекуле CH4 не удалось опытным путем обнаружить отдельных связей, образованных s-электронами и отдельных связей - образованных p-электронами (все связи в CH4 одинаковы). Поэтому принято, что одна s- и три p-орбитали “смешиваются” (гибридизуются), образуя 4 новые, совершенно одинаковые орбитали (четыре sp3-гибридные орбитали). Эти 4 гибридные орбитали перекрываются с электронными оболочками 4-х атомов Н. Геометрическую формулу образовавшейся молекулы предсказывают исходя из правила, что гибридные орбитали в молекуле стремятся расположиться на максимальном расстоянии друг от друга. Например, для 4-х гибридных орбиталей это тетраэдр. В тех случаях, когда одна или две p-орбитали не участвуют в гибридизации, они остаются в негибридизованном виде и либо не несут электронов, либо участвуют в связывании другого типа (двойные и тройные связи). Это соответственно sp2- и sp-гибридизации. НЕПОДЕЛЕННЫЕ электронные ПАРЫ тоже участвуют в гибридизации. Например, аммиак :NH3 - sp3-гибридизация атома N, молекула имеет форму тетраэдра, одна из вершин которого - неподеленная пара электронов, оставшиеся три - атомы Н. В различных гибридизациях вместе с s- и p-орбиталями могут участвовать также и d-орбитали (sp3d- и sp3d2-гибридизации). | |
гидратациясвязывание молекул (атомов, ионов вещества) с водой, не сопровождающееся разрушением молекул воды. | |
гидроксидная группа- группа ОН | |
гомогенные реакции- химические реакции, протекающие в однородной фазе. Обычно это реакции либо в газовой фазе (реакции между газами), либо в жидкой фазе (реакции между растворами). Гомогенные реакции протекают во всем объеме реакционного сосуда - в этом их принципиальное отличие от гетерогенных реакций | |
Д |
|---|
дефект массы- уменьшение массы атома по сравнению с суммарной массой всех отдельно взятых составляющих его элементарных частиц, обусловленное энергией их связи в атоме. | |
дистилляциясм. перегонка. | |
диффузия- самопроизвольное выравнивание концентрации веществ в смеси, обусловленное тепловым движением молекул. Перенос частиц вещества, приводящий к выравниванию его концентрации в первоначально неоднородной системе. Искусственное перемешивание смеси действует в том же направлении. | |
длина волны- расстояние между соседними пиками волн электромагнитного (светового) излучения. | |
донорные свойстваспособность атомов элемента отдавать свои электроны другим атомам. Количественной мерой донорных свойств атомов, образующих химическую связь, является их электроотрицательность. | |
З |
|---|
закон АвогадроРавные объемы любых газов (при одинаковых температуре и давлении) содержат равное число молекул. 1 МОЛЬ любого газа при нормальных условиях занимает объем 22,4 л. | |
закон сохранения массыМасса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции. | |
заряд ядраположительный заряд атомного ядра, равный числу протонов в ядре данного элемента. Порядковый номер химического элемента в Периодической системе Д.И.Менделеева равняется заряду ядра атома этого элемента. | |
И |
|---|
изотопыатомные разновидности одного и того же элемента. Изотопы состоят из атомов с одинаковым зарядом ядра (то есть с одинаковым числом протонов), но с разными относительными атомными массами (то есть с разным числом нейтронов в ядре). Очень многие элементы в природе находятся в виде смеси из несколько изотопов. | |
ингибиторы- вещества, замедляющие химические реакции. | |
индикаторы- вещества сложного строения, имеющие разную окраску в растворах кислот и оснований. Бывают индикаторы и для других веществ (не кислотно-основные). Например, крахмал - индикатор на появление в растворе иода (дает синюю окраску). | |
инициаторы- вещества, добавление которых к реагентам в ряде случаев необходимо для возбуждения химической реакции, которая далее происходит без посторонней помощи. Инициаторы расходуются в ходе реакции, поэтому их не надо путать скатализаторами. | |
ионная связь- предельный случай полярной ковалентной связи. Связь между двумя атомами считается ионной, если разница электроотрицательностей этих атомов больше или равняется 2,1. | |
ионы- отрицательно или положительно заряженные частицы, образующиеся при присоединении или отдаче электронов атомами элементов (или группами атомов). Ионы бывают однозарядные (1+ или 1-), двухзарядные (2+ или 2-), трехзарядные и т.д. См. также "катионы" и "анионы". | |
ИЮПАК (IUPAC)Международный союз теоретической (чистой) и прикладной химии (International Union of Pure and Applied Chemistry). Организация, созданная в 1919 году. Входит в Международный совет научных союзов. Координирует исследования, требующие международного согласования, контроля и стандартизации, рекомендует и утверждает химическую терминологию. | |
К |
|---|
катализаторы- вещества, способные ускорять химические реакции, сами оставаясь при этом неизменными. | |
катионы- положительно заряженные ионы. | |
квантовые числа- описывают состояние конкретного электрона в электронном облаке атома: - ГЛАВНОЕ (n) - показывает, на каком электронном уровне, начиная от ближайшего к ядру (1, 2, 3, ... ) находится данный электрон; - ВСПОМОГАТЕЛЬНОЕ или ОРБИТАЛЬНОЕ (l) - показывает вид подуровня (s-подуровень, p-подуровень, d-подуровень, f-подуровень); - МАГНИТНОЕ (m) - указывает конкретную орбиталь (s-орбиталь, px-орбиталь, py-орбиталь и т.д.); - СПИНОВОЕ (s) - показывает, какое из двух возможных (разрешенных) состояний занимает электрон на данной орбитали. | |
кислота- сложное вещество, в молекуле которого имеется один или несколько атомов водорода, которые могут быть замещены атомами (ионами) металлов. Оставшаяся часть молекулы кислоты называется кислотным остатком. Еще одно определение: кислоты – вещество, распадающееся в растворе с образованием ионов водорода Н+. **Кислотные свойства веществ не обязательно исчерпываются способностью давать в растворе ионы водорода. | |
КЛАПЕЙРОНА-МЕНДЕЛЕЕВА УРАВНЕНИЕ:PV = nRT. | |
ковалентная связьсвязывание атомов с помощью общих (поделенных между ними) электронных пар. Неполярная ковалентная связь образуется между атомами одного вида. Полярная ковалентная связь существует между двумя атомами в том случае, если их электроотрицательности не одинаковы. | |
концентрация- относительное количество какого-либо вещества в растворе. | |
координационное чмслок каждой частице, находящейся в кристалле, примыкает вплотную только определенное число соседних частиц. Это различное для разных кристаллов число соседних частиц называется координационным числом. | |
кристаллизация- способ очистки вещества путем осаждения его из насыщенного раствора. Обычно насыщенный раствор вещества готовится при повышенной температуре. При охлаждении раствор становится пересыщенным и чистые кристаллы выпадают в осадок. Примеси, по которым раствор остается ненасыщенным, остаются в растворителе и отфильтровываются от кристаллов. | |
кристаллическая решетка- Кристаллическая структура характеризуется правильным (регулярным) расположением частиц в строго определенных точках пространства кристалла. При мысленном соединении этих точек линиями получаются пространственный каркас, который называют кристаллической решеткой. Точки, в которых размещены частицы, называются узлами кристаллической решетки. В узлах могут находиться ионы, атомы или молекулы. Кристаллическая решетка состоит из совершенно одинаковых элементарных ячеек (см. "элементарная ячейка"). | |
кристаллогидратыкристаллические гидраты (соединения вещества с водой), имеющие постоянный состав. Выделяются из растворов многих веществ, особенно солей. | |
М |
|---|
массовое числосумма числа протонов (Z) и нейтронов (N) в ядре атома какого-либо элемента (A = Z + N). | |
металлическая связь- химическая связь в кристалле между положительно заряженными ионами металла посредством свободно перемещающихся (по всему объему кристалла) электронов с внешних оболочек атомов металла. | |
молекуланаименьшая частица какого-либо вещества, определяющая его химические свойства и способная к самостоятельному существованию. Молекулы состоят из атомов. | |
молекулярная орбитальэлектронное облако, образующееся при слиянии внешних электронных оболочек атомов (атомных орбиталей) при образовании между ними химической связи. Молекулярные орбитали образуются при слиянии двух или нескольких атомных орбиталей. Число молекулярных орбиталей всегда равно числу взаимодействующих атомных орбиталей. Все валентные электроны связывающихся атомов располагаются на вновь образованных молекулярных орбиталях. | |
молекулярность- число исходных частиц (например молекул, ионов), одновременно взаимодействующих друг с другом в одном элементарном акте реакции. | |
моль- количество вещества, равное 6,022.1023 структурных единиц данного вещества: молекул (если вещество состоит из молекул), атомов (если это атомарное вещество), ионов (если вещество является ионным соединением). Число 6,022.1023 называется постоянной Авогадро или числом Авогадро. | |
молярная массамасса одного моля вещества в граммах называется молярной массой вещества или грамм-молем (размерность г/моль). Численное выражение молярной массы (грамм-моля) в граммах совпадает с молекулярным весом (или атомным, если вещество состоит из атомов) в единицах а.е.м. | |
молярностьконцентрация раствора, выраженная в молях растворенного вещества на 1 литр раствора. Обозначается буквой М. Например, 1М NaOH - это раствор NaOH с концентрацией 1 моль/л. | |
Н |
|---|
нейтронэлектрически нейтральная элементарная (т.е. неразделимая) частица с массой примерно 1,67.10–27 кг или 1,00867 а.е.м. Нейтроны вместе с протонами входят в состав атомных ядер. | |
неподеленная электронная пара- внешняя электронная пара атома, не участвующая в образовании химической связи. | |
нормальные условияназывают температуру 0 оС (273 K) и давление 1 атм (760 мм ртутного столба или 101 325 Па). Не путать со СТАНДАРТНЫМИ УСЛОВИЯМИ! | |
нуклоныэлементарные частицы (протоны и нейтроны), входящие в состав ядра атома. | |
О |
|---|
Обобществленные электроныэлектроны, которые осуществляют химическую связь, возникающую вследствие перекрывания электронных оболочек, и являются общими для связываемых атомных остовов | |
окисление- химическая реакция, при которой электроны отбираются у данного вещества окислителем. | |
окислитель- вещество, способное отнимать электроны у другого вещества (восстановителя). | |
окислительно-восстановительные реакции- реакции всех перечисленных выше типов, в которых происходит изменение степени окисления каких-либо атомов в реагирующих молекулах. | |
оксиды- сложные вещества, состоящее из атомов двух элементов, один из которых - кислород. | |
орбиталь- пространство около ядра, в котором можно обнаружить электрон. За пределами этого пространства вероятность встретить электрон достаточно мала (менее 5%). | |
основание- сложное вещество, в котором атом (или атомы) металла связаны с гидрокси-группами (ОН-группами). Растворимые основания могут распадаться в растворе с образованием гидроксид-ионов ОН-. **Основные свойства веществ не обязательно исчерпываются способностью давать в растворе ионы ОН-. | |
основание амфотерноесложное вещество, способное проявлять как кислотные, так и основные свойства в зависимости от партнера по реакции. Амфотерное основание способно отдавать как ионы водорода Н+ в реакциях с обычными основаниями, так и гидрокси-группы ОН- в реакциях с обычными кислотами. См. также "амфотерность" и "амфолиты". | |
относительная атомная массаобозначается символом Ar ("r" - от английского "relative" - относительный) - отношение массы атома к массе 1/12 атома углерода-12 (см. а.е.м.). | |
П |
|---|
переходное состояние- короткоживущая молекула, возникающая в химической реакции при переходе от начального состояния (реагенты) в конечное (продукты). Энергия и геометрия переходного состояния соответствуют вершине энергетического барьера, разделяющего реагенты и продукты (см. также ЭНЕРГИЯ АКТИВАЦИИ). | |
Периодический закон Д.И. МенделееваСвойства элементов периодически изменяются в соответствии с зарядом ядер их атомов. | |
подоболочка- часть электронной оболочки, состоящая из орбиталей одного вида. Например, пять d-орбиталей составляют d-подоболочку (d-подуровень), три р-орбитали - р-подоболочку (p-подуровень) и т.д. | |
поляризация- разделение положительных и отрицательных зарядов. | |
порядок реакции- по данному веществу - показатель степени при концентрации этого вещества в кинетическом уравнении. Сумма порядков по всем веществам называется общим или суммарным порядком реакции. Например, для реакции 2 NO + O2 = 2 NO2: кинетическое уравнение v = k[NO]2[O2]; второй порядок по NO, первый порядок по O2, общий (суммарный) порядок реакции 3. Для элементарных реакций порядок - целочисленная величина, совпадающая с МОЛЕКУЛЯРНОСТЬЮ РЕАКЦИИ. Для других реакций порядки определяются только экспериментально, причем они могут иметь как целочисленное, так и дробные (и даже нулевое) значение. | |
Постоянная Авогадро6,022.1023. | |
Правило ГундаПри заселении орбиталей с одинаковой энергией (например, пяти d-орбиталей) электроны в первую очередь расселяются поодиночке на вакантных ("пустых") орбиталях, после чего начинается заселение орбиталей вторыми электронами. | |
Правило октетаАтомы элементов стремятся к наиболее устойчивой электронной конфигурации. Самая распространенная устойчивая электронная конфигурация – с завершенной внешней электронной оболочкой из 8 электронов (с октетом электронов). | |
Принцип ПаулиНикакие два электрона в одном атоме не могут характеризоваться одинаковым набором всех четырех квантовых чисел n, l, m и s. | |
Промотрывещества, сами по себе не являющиеся катализаторами данной реакции, но усиливающие действие основного катализатора | |
простое веществовещество, которое состоит из атомов только одного элемента или из молекул, построенных из атомов одного элемента. Примеры: железо, кислород, алмаз, аргон, медь и т.д. | |
протонустойчивая элементарная (т.е. неразделимая) частица с элементарным (т.е. наименьшим из возможных) положительным электрическим зарядом и массой 1,67.10-27 кг (или 1,00728 а.е.м.). Протоны вместе с нейтронами входят в состав атомных ядер. Порядковый номер химического элемента в Периодической системе Д.И.Менделеева равняется числу протонов в ядре атома этого элемента. | |
Р |
|---|
раствор насыщенный- раствор, в котором данное вещество при данной температуре уже больше не растворяется. Насыщенный раствор находится в динамическом равновесии с нерастворившимся веществом. | |
растворимостьспособность вещества растворяться в том или ином растворителе. Мерой растворимости вещества при данных условиях является его содержание в насыщенном растворе. | |
растворительИз двух или нескольких компонентов раствора растворителем называется тот, который взят в большем количестве и имеет то же агрегатное состояние, что и у раствора в целом. | |
растворы- называют физико-химические однородные смеси переменного состава, состоящие из двух или нескольких веществ и продуктов их взаимодействия. | |
реагенты- исходные вещества в химической реакции. Формулы реагентов записываются всегда в левой части уравнения химической реакции. | |
С |
|---|
скорость реакции- количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объема системы. Имеет размерность моль/л сек-1. | |
сложное вещество- вещество, которое состоит из молекул, построенных из атомов разных элементов. Примеры: соль, сахар, диоксид углерода, бензин, вода и т.д. | |
смесь- вещество, состоящее из молекул или атомов двух или нескольких веществ (неважно - простых или сложных). Вещества, из которых состоит смесь, могут быть разделены. Примеры: воздух, морская вода, сплав двух металлов, раствор сахара и т.д. | |
солисложные вещества, в которых атомы металла связаны с кислотными остатками. | |
стандартная энтальпия образования-тепловой эффект реакции образования данного вещества из элементов при определенных условиях. | |
стандартные условия- состояние вещества при 25 oC (298 К) и 1 атм (1,01.105 Па), а для простых веществ, кроме того, состояние в наиболее устойчивой при этих условияхАЛЛОТРОПНОЙ МОДИФИКАЦИИ. Например, для углерода стандартным состоянием является графит, но не алмаз. | |
степень окисленияПри образовании химических связей между атомами электроны частично передаются от менее электроноакцепторных атомов к более электроноакцепторным атомам. Количество отданных или принятых атомом электронов называется степенью окисления атома в молекуле. При связывании разных атомов степень окисления равна заряду, который приобрел бы атом в этом соединении, если бы оно могло состоять из одних ионов. Описывает состояние атома в молекуле. | |
структурные формулы- изображение молекулы, в котором показан порядок связывания атомов между собой. Химические связи в таких формулах обозначаются черточками. Например, структурные формулы: Cl-Ca-Cl (молекула CaCl2), O=С=O (молекула СО2) и т.д. Рекомендуется в структурных формулах изображать также и НЕПОДЕЛЕННЫЕ ПАРЫ электронов. | |
субатомные частицы (элементарные частицы)- ряд различных по своим свойствам микрочастиц, из которых состоят атомы. Название "элементарные" было принято в связи с тем, что эти частицы считались неразложимыми на составные части. Однако, это свойство субатомных частиц условно, т.к. в настоящее время установлено, что они тоже являются сложными физическими объектами. | |
Т |
|---|
тепловой эффект реакции- теплота, выделенная или поглощенная при протекании химической реакции. Обычно обозначается символами Q или DE. При постоянном давлении ТЕПЛОВОЙ ЭФФЕКТ РЕАКЦИИ (DE) равен изменению ЭНТАЛЬПИИ (DH). В термохимической системе знаков положительным считается тепловой эффект экзотермической реакции (в которой тепло выделяется "наружу"). В термодинамической системе знаков тепловой эффект экзотермической реакции считается отрицательным (Q = -DH).
| |
типы химических реакций- СОЕДИНЕНИЯ - когда два (или более) вещества-реагента соединяются в одно, более сложное вещество; - РАЗЛОЖЕНИЯ - когда одно сложное исходное вещество разлагается на два или несколько более простых; - ОБМЕНА - когда реагенты обмениваются между собой атомами или целыми составными частями своих молекул. - ЗАМЕЩЕНИЯ - реакции обмена, в которых участвует какое-либо простое вещество, замещающее один из элементов в сложном веществе; - НЕЙТРАЛИЗАЦИИ - (важная разновидность реакций обмена): реакции обмена между кислотой и основанием, в результате которых образуется соль и вода; | |
титрование- способ определения МОЛЯРНОСТИ раствора вещества А с помощью раствора вещества Б, которое реагирует с веществом А. К точно отмеренному объему исследуемого раствора А по каплям добавляют раствор Б известной концентрации. Окончание реакции определяют с помощью ИНДИКАТОРА. По объему израсходованного раствора Б судят о числе молей вещества А в отобранной пробе и во всем растворе А. | |
Ф |
|---|
физические явления- явления, не сопровождающиеся превращением одних веществ в другие путем разрыва и образования связей в их молекулах. | |
Х |
|---|
Химическая связьобменно-электростатическое взаимодействие атомных остовов (или ядер) посредством обобществленных электронов в химических соединениях, возникающее в результате перекрывания электронных оболочек связывающихся атомов и обобществления электронов | |
химические реакции (химические явления)явления, при которых одни вещества, обладающие определенным составом и свойствами, превращаются в другие вещества - с другим составом и другими свойствами. При этом в составе атомных ядер изменений не происходит. Химические явления называют иначе химическими реакциями. | |
химия- наука о веществах и законах, по которым происходят их превращения в другие вещества. | |
Щ |
|---|
щелочь- растворимое в воде сильное основание. Все щелочи (NaOH, KOH. Ba(OH)2) в растворах распадаются на катионы металлов и гидроксид-ионы ОН-. | |
Э |
|---|
экзотермические реакции- химические реакции, протекающие с выделением тепла. | |
экология- наука, изучающая взаимоотношения живых организмов с окружающей средой. | |
электронустойчивая элементарная (т.е. неразделимая) частица с элементарным (т.е. наименьшим из возможных) отрицательным электрическим зарядом и массой 9,11.10-31 кг. Электроны являются составной частью атомов всех элементов. Обладают свойствами как частиц, так и волн. | |
электронная конфигурация-распределение электронов по энергетическим уровням, существующим в электронном облаке атома. Электронную конфигурацию описывают разными способами: а) с помощью электронных формул, б) с помощью орбитальных диаграмм (см. “электронная формула”, электронная ячейка”). | |
электронная пара- два электрона, осуществляющие химическую связь. См. также "неподеленная пара". | |
электронная формула- запись распределения имеющихся в атоме электронов по энергетическим уровням и орбиталям. Например, электронная формула кислорода (элемент номер 8, атом содержит 8 электронов): 1s2 2s2 2p4. | |
электронная ячейкаизображение атомной орбитали в виде квадратика, в котором располагаются (или не располагаются) электроны в виде вертикальных стрелок. | |
электроотрицательностьотносительная способность атомных ядер притягивать к себе электроны, образующие химическую связь. Характеризует способность атома к поляризации химических связей. Электроотрицательность различных атомов можно оценить количественно - см. таблицу в приложении VII (вход на главной странице). | |
элемент- вещество, состоящее из атомов одного вида (из атомов с одинаковым зарядом ядра). Часто элемент содержит в своем составе несколько ИЗОТОПОВ. | |
эндотермические реакции- химические реакции, протекающие с поглощением тепла. | |
энтальпия- "теплосодержание" реагирующих веществ. Обозначается как DH. При постоянном давлении (если реакция идет не в замкнутом сосуде) изменение энтальпии в процессе химической реакции равно её ТЕПЛОВОМУ ЭФФЕКТУ. | |
Я |
|---|
ядерные реакции- превращение одних веществ в другие, но не путем разрыва и образования химических связей, а путем изменения строения ядер элементов, участвующих в таких реакциях. | |