Глоссарий (словарь химических терминов)
приведены основные термины курса
Специальные | А | Б | В | Г | Д | Е | Ё | Ж | З | И | К | Л | М | Н | О | П | Р | С | Т | У | Ф | Х | Ц | Ч | Ш | Щ | Э | Ю | Я | Все
А |
|---|
атом- наименьшая частица химического элемента, являющаяся носителем его свойств. Атом построен из субатомных частиц - протонов, нейтронов, электронов. | |
атомный номер- то же, что порядковый номер элемента в Периодической системе Д.И.Менделеева. Атомный номер численно равен положительному заряду ядра этого элемента, т.е. числу протонов в ядре данного элемента. | |
атомный остовядро с частью электронной оболочки атома, не принимающей участия в образовании химической связи (то есть необобществленные электроны в совокупности с ядром) | |
В |
|---|
валентность- число электронных пар, с помощью которых атом данного элемента связан с другими атомами. | |
водородная связьодин из видов межмолекулярных связей. Обусловлена в основном электростатическими силами. Для возникновения водородной связи нужно, чтобы в молекуле был один или несколько атомов водорода, связанных с небольшими, но электроотрицательными атомами, например: O, N, F. Например, молекулы HF связаны между собой водородными связями, которые на рисунке показаны пунктирными линиями:
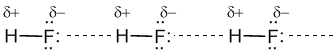 | |
восстановительвещество, способное отдавать электроны другому веществу (окислителю). | |
восстановление- химическая реакция, при которой электроны передаются данному веществу. | |
Г |
|---|
гетерогенные реакции- это химические реакции между веществами, находящимися в разных фазах (разных агрегатных состояниях вещества). Например, реакция горения угля - гегерогенная реакция между твердым углеродом и газообразным кислородом. Гетерогенные реакции протекают не в объеме, а на границе раздела фаз - в этом их принципиальное отличие от гомогенных реакций. | |
гибридизация- Теоретическое представление, с помощью которого удается связать между собой физическую картину строения атома и определяемую опытным путем геометрию молекул . Например, атом углерода имеет s- и p-орбитали, но в молекуле CH4 не удалось опытным путем обнаружить отдельных связей, образованных s-электронами и отдельных связей - образованных p-электронами (все связи в CH4 одинаковы). Поэтому принято, что одна s- и три p-орбитали “смешиваются” (гибридизуются), образуя 4 новые, совершенно одинаковые орбитали (четыре sp3-гибридные орбитали). Эти 4 гибридные орбитали перекрываются с электронными оболочками 4-х атомов Н. Геометрическую формулу образовавшейся молекулы предсказывают исходя из правила, что гибридные орбитали в молекуле стремятся расположиться на максимальном расстоянии друг от друга. Например, для 4-х гибридных орбиталей это тетраэдр. В тех случаях, когда одна или две p-орбитали не участвуют в гибридизации, они остаются в негибридизованном виде и либо не несут электронов, либо участвуют в связывании другого типа (двойные и тройные связи). Это соответственно sp2- и sp-гибридизации. НЕПОДЕЛЕННЫЕ электронные ПАРЫ тоже участвуют в гибридизации. Например, аммиак :NH3 - sp3-гибридизация атома N, молекула имеет форму тетраэдра, одна из вершин которого - неподеленная пара электронов, оставшиеся три - атомы Н. В различных гибридизациях вместе с s- и p-орбиталями могут участвовать также и d-орбитали (sp3d- и sp3d2-гибридизации). | |